利用电化学电池进行CO2还原是一种很有吸引力的技术,可以将可再生电力以化学形式存储。由于C-O键的保留,中间体对氧的优先吸附可提高甲醇的选择性。然而,吸附剂与表面的相互作用主要与催化剂中过渡金属的d-态有关,因此很难在不影响碳亲和力的情况下促进氧结合中间体的形成。
物质绿色创造与制造海河实验室科研骨干巩金龙教授(通讯作者)等人报道了一种将金属的d-态与碳的s-态混合的策略,该策略促进了在吸附质表面成键变化过程中产生的催化剂的sp态的显著变化,从而可以避免碳和氧吸附能之间的相互依赖。钼(Mo)基碳化物纳米颗粒(Mo2C/N-CNT)被选为候选催化剂,因为Mo位点被证明在二氧化碳加氢过程中稳定CxHyOz中间体。在-1.1 V时,Mo2C/N-CNT的最高甲醇高法拉第效率(FE)达到了80.4%。
密度泛函理论(DFT)计算和原位红外光谱结合,确认了具有氧结合构型的中间体的优选形成。作者假设了一种新的可能的CH3OH形成途径与传统的CO途径并行,其特征在于甲酰基(*OCHO*,一种氧结合物种)作为代表性中间体的存在,可以避免中间体中氧原子的进一步损失,以促进CH3OH的形成。该工作提供了一个额外的维度来调整比例,以设计更好的催化剂。
以下为转载内容

背景介绍
可再生电力驱动的高选择性CO2还原反应(CO2RR),是一种很有前景的碳中和技术。为提高CO2RR的选择性,调节中间体(CxHyOz)在催化剂表面的吸附能和构型是一种特别有效的方法。近年来,利用特定的面或低配位调控催化剂等策略是有效的,但甲醇(CH3OH)等氧合物的选择性生成率较低,尤其依赖于中间产物的吸附能和构型,因为相应的速率决定步骤(RDS)通常需要质子的参与。如果中间产物的碳原子与金属表面成键,则中间产物的氧原子会被定位在远离金属表面的位置,使得电解液中的质子更容易攻击氧原子,从而导致氧原子的损失,氧的选择性降低。
为促进CH3OH等氧合物的选择性生成,催化剂表面应表现出适当的亲氧性,从而诱导中间产物通过氧原子部分或全部吸附在表面,以减少氧的损失。根据Nørskov等人提出的d带理论,吸附质在过渡金属表面的结合涉及过渡金属的d态和sp态的相互作用,但sp态对成键能的变化几乎没有贡献。在一定程度上,这种情况导致了碳和氧吸附能间存在正相关关系,限制了催化剂表现出亲氧性质,而对碳亲和力影响不大,以避免氧的损失。
图文解读
Mo-基碳化物催化剂的表征
作者将颗粒负载到N掺杂碳纳米管(N-CNT)上,利用Mo和N位点间的强金属载体相互作用来驱动颗粒的空间分散。在合成过程中,首先通过在N2下加热原料CNT和尿素的混合物将N位点引入到CNT中。随后,通过在N2气氛下加热获得的N-CNT(其中钼酸铵用作金属源),将Mo-基碳化物纳米颗粒锚定在N-CNT上。然后,在室温下使用1vol% O2进行原位表面钝化。TEM表明,形成了均匀分散的颗粒 纳米直径锚定在N-CNT上。HR-TEM显示,d-间距为0.23和0.26 nm的晶格条纹 ,分别对应于六边形Mo2C(β-Mo2C)的(101)和(100)平面,而没有对应于氧化物的明显晶格出现。因此,所获得的催化剂被称为Mo2C/N-CNT。
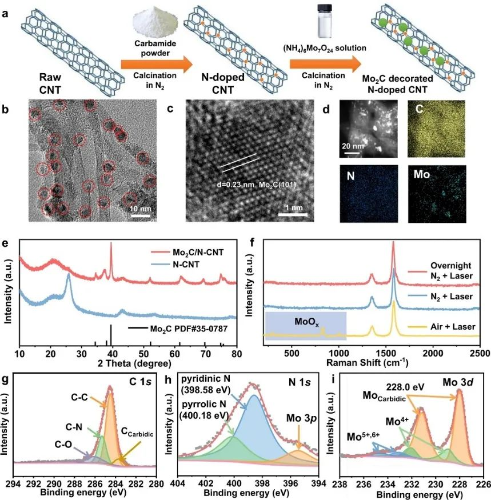
图1. Mo2C/N-CNT的形态和化学状态
Mo-基碳化物促进合成CH3OH
作者利用了高压连续鼓泡CO2还原系统,以增加CO2及相关中间体的表面覆盖率。CO2在40 atm下的溶解度达到0.95 M(4 MPa),CO2分子溶解在水中会形成H2CO3,而H2CO3可以解离获得质子,因此CO2溶解量的增加会降低电解质的总体pH值和局部pH值。当电位降低到−1.1 V时,CH3OH的选择性达到80.4%(对应的周转频率为2.2×10-2 s-1,周转数为238.6)。在高过电位条件下,CH4的选择性逐渐增加,表明在高CO2压力条件下,Mo2C/N-CNT表面更容易生成CH3OH而不是CH4。该催化剂对CH3OH具有较高的选择性,且具有较大的电流密度(>4 mA/cm2)。
图2. Mo2C/N-CNT的CO2RR性能
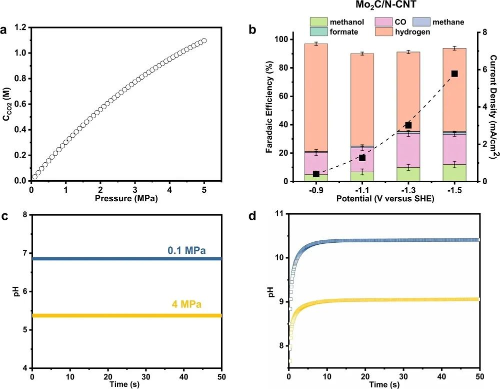
图3. CO2压力对催化剂性能影响的研究
机理研究
为探索Mo2C/N-CNT表面的反应途径,首先在40 atm CO下进行CO还原反应(CORR),带来更高的*CO覆盖率。在CO还原条件下,CH3OH的选择性远低于CO2RR。作者计算了*CO的解吸自由能,发现*CO在Mo2C/N-CNT表面的解吸自由能显著降低,不利于*CO在Mo2C/N-CNT表面的后续转化。结果表明,CH2O*可能是Mo2C/N-CNT表面生成CH3OH的中间产物,CH3OH可能同时存在于CO2还原和CO还原过程中。在CO2还原过程中,Mo2C/N-CNT表面生成CH4可能主要通过CO途径。Mo2C/N-CNT表面在1800-2100 cm-1之间,没有检测到明显的*CO拉伸振动吸收峰,表明Mo2C/N-CNT表面的*CO结合不强。
从热力学方面,羟基修饰的Mo2C表面(与Mo2C/N-CNT有关)更倾向于吸收*OCHO*中间体,而不是*COOH中间体,因此CO2在反应开始时更倾向于转化为*OCHO*。根据原位ATR-SEIRAS和DFT的计算结果,*CO很容易从Mo2C/N-CNT表面脱附,不利于后续的转化。生成*OCHO*后,还原得到H2C*O*OH中间体,进一步反应生成CH2O*和CH3OH。
图4. CO2还原制CH3OH的反应机理
文献信息
Selective CO2 electroreduction to methanol via enhanced oxygen bonding. Nature Communications, 2022, DOI: 10.1038/s41467-022-35450-8.
https://doi.org/10.1038/s41467-022-35450-8.



